AI-powered spatial cell phenomics enhances risk stratification in non-small cell lung cancer

作者:
Simon Schallenberg1,23, Gabriel Dernbach1,2,23, Sharon Ruane
期刊:nature communication
重要指数:⭐️⭐️⭐️⭐️⭐️
时间:25.10.23
关键词: 肿瘤微环境(TME)\多重免疫荧光\细胞生态位\风险分层
摘要:风险分层仍是非小细胞肺癌患者选择最佳治疗方案的关键挑战。本研究开发了一种基于人工智能的空间细胞组学方法,通过整合组织学、多重免疫荧光成像和多模态机器学习技术,对来自德国两家大型癌症中心的1168例非小细胞肺癌患者真实世界回顾性队列中43种肿瘤微环境细胞表型的复杂细胞关系进行表征。该模型识别出与生存相关的细胞微环境,并在肺腺癌和鳞状细胞癌这两种主要非小细胞肺癌亚型中,分别将风险分层准确率提升14%和47%,实现了微环境模式与传统癌症分期的结合。研究结果表明,复杂的免疫细胞微环境模式可识别潜在未充分治疗的高危患者,这些患者符合辅助治疗的适应症。本方法凸显了基于人工智能的多重成像分析在深入理解肿瘤微环境对癌症进展的贡献、以及改善非小细胞肺癌风险分层和治疗选择方面的潜力。
1.研究背景
-
目前有ICC、TKI等多种药物,死亡率仍高。目前分层金标准:肿瘤大小(T)、区域淋巴结转移(N)及远处转移(M)。虽然早期 UICC 分期(I-III期)患者通常接受根治性手术治疗,但约半数患者会出现复发且预后不良,因此常需辅助化疗以提高生存率。
-
想要寻找新型预后及预测性生物标志物难。与既定的分期和分级系统不同,以及当前突变谱分析主要聚焦于癌细胞的现状,本研究探讨了肿瘤微环境(TME)对疾病进展的影响及其潜在临床价值。TME是一个复杂生态系统 ,包括免疫细胞、基质细胞、血管化细胞外基质及其空间关系。近年来,TME在癌症 发生、进展和治疗响应中的关键作用被认可。多项研究显示特定免疫细胞亚群(如 淋巴细胞)具有预后意义。在NSCLC中,淋巴细胞亚群密度、组合丰度和细胞间距离 独立贡献预后信息;调节性和细胞毒性T细胞的空间分布与肿瘤分期、进展密切相关 。
-
目前大多数的局限:大多数研究仅关注选定细胞类型、细胞计数或功能,忽略复杂空间关系和异质分布 。里程碑研究(如Galon等在结肠癌中证明免疫细胞定位影响结局,后在大队列验证 )以及乳腺癌研究显示高基质免疫浸润与更好治疗响应相关,但这些研究仅分析有限细胞类型或聚合水平比较肿瘤/基质区域。
-
研究假设认为,捕捉TME复杂性需要数据驱动的AI整合分析。Keren等在小队列中使用多重成像+AI扩展细胞类型并在空间分辨率分析,获得更全面TME理解。但以往工作限于小队列、精选患者,缺乏多样性。本研究覆盖临床常规患者全谱,检验现有分期系统与肿瘤空间细胞组成交互。
-
纳入1168例接受手术切除的I-IV期 NSCLC 患者,我们为此开发了一套可扩展的基于人工智能的自动化分析流程。该方法整合了14种不同的人工智能模型,分别用于组织分割、细胞检测和细胞分类,随后采用可解释的机器学习方法,通过结合细胞表型和细胞定位来预测患者预后。我们共识别出5300万个细胞,其类型和空间位置均被纳入临床人工智能模型。基于细胞密度特征,我们识别出具有特定免疫状态的不同癌亚型、通过整合细胞表型与细胞定位特征识别出10个具有空间分辨率的细胞微环境,称为“细胞生态位”
2.研究框架
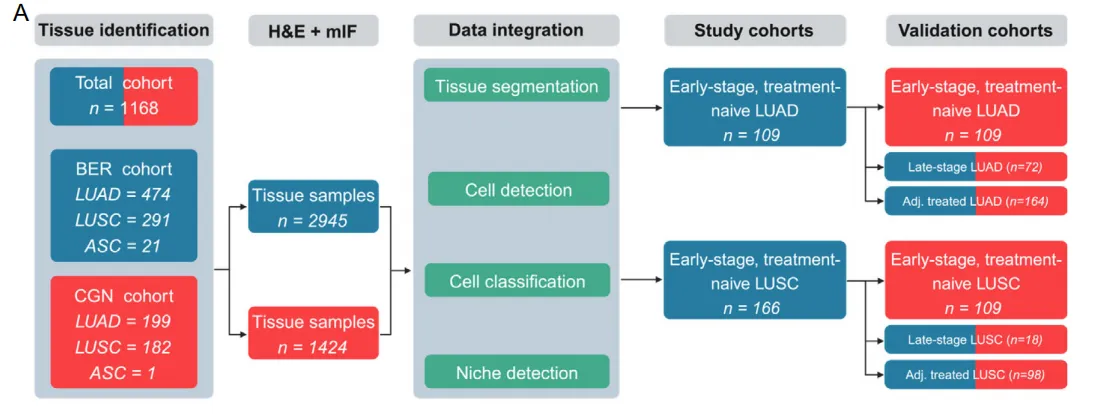
患者筛选与数据整合流程图
样本准备:1168名NSCLC患者(Berlin和Cologne中心,2006-2019手术切除,I-IV期)。
每患者取4个1.5mm肿瘤核心,组装TMA。 染色:12-plex mIF(标记:CK、CD3、CD4、CD8、CD20、CD56、CD68、CD163、FOXP3、GrB、PD-1、PD-L1)+ H&E。
组织分割:UNet模型区分癌、基质、坏死、健康组织
细胞检测:StarDist模型检测细胞核
细胞分类:12个独立ConvNeXt模型,二元分类每个标记,组合成43个表型
生态位检测:每个细胞计算34µm邻域内标记频率,kmeans聚类成10个原型,得到肿瘤水平生态位分布
最后进行下游分析,细胞密度/生态位聚类,生存预测(Cox模型) → 风险分层
3.研究实验与数据分析
Fig 1 队列描述与细胞表型组学分析流程
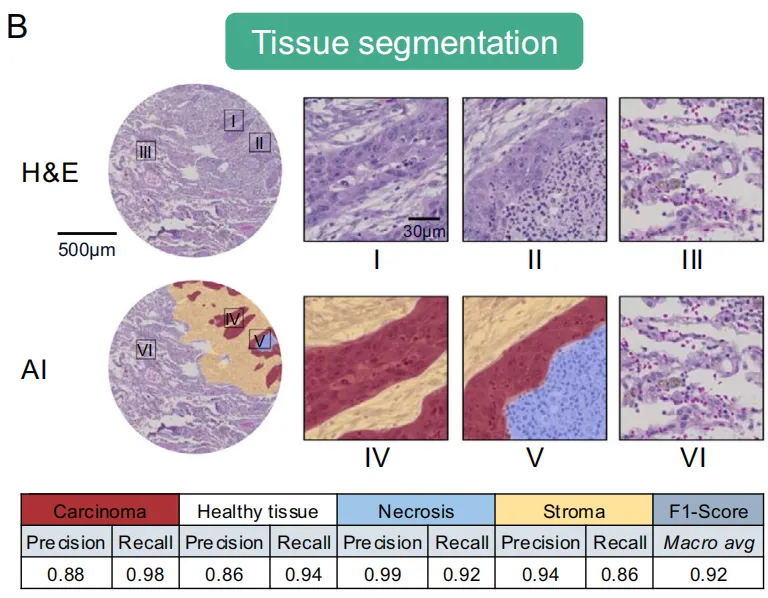
UNet架构的深度卷积神经网络对癌组织、坏死组织、肿瘤间质及健康组织进行分割训练。主动学习模式迭代进行,并在病理学家参与的闭环监督。F1分数0.92
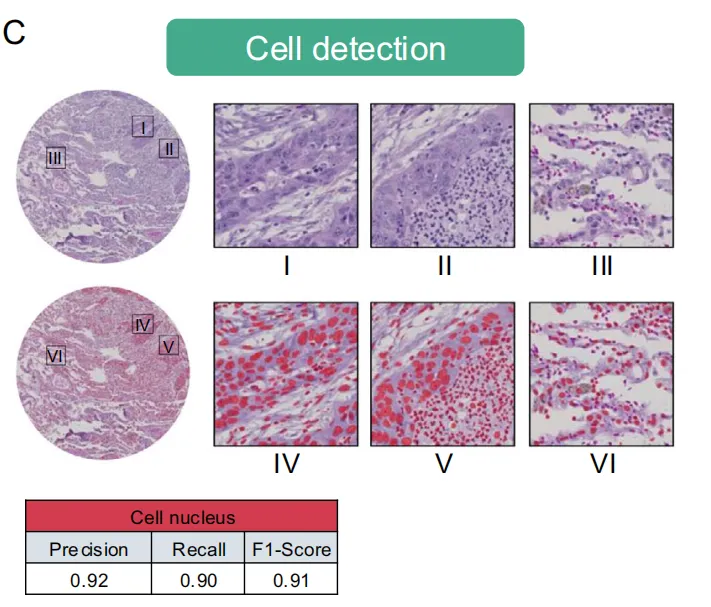
优化版本StarDist32——这是一种基于UNet的物体检测模型,通过星形凸多边形预测层检测细胞核,该模型在超过10万个病理学家标注的多种组织类型细胞核数据上进行了微调。效果好,F1分数0.91
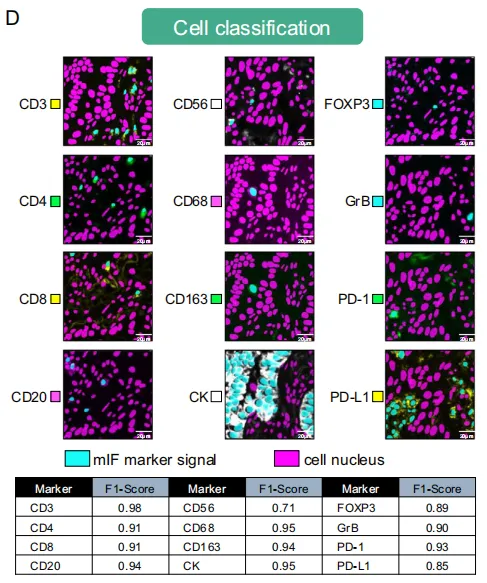
细胞分类任务被建模为一个多标签分类任务,采用12个独立模型——每个mIF通道一个——并使用ConvNext33架构。抵消聪明汉斯效应:在实验或观察中,被试(人或动物)并非真正具备研究者所声称的能力,而是通过无意中泄露的线索(cue)从实验者或环境中“读出”正确答案,导致产生虚假的“智能”或“效果”表现。在构建预后模型时,如果训练数据和验证数据存在隐含的批次效应(batch effect,如不同医院的染色差异、扫描仪差异),模型可能只是捕捉了这些“人工痕迹”而非真正的生物学信号——这就是典型的聪明汉斯效应。0.91的平均F1分数
通过比较局部标记物频率(34 µm 半径内)与通过聚类获得的原型分布,推导出微环境组成
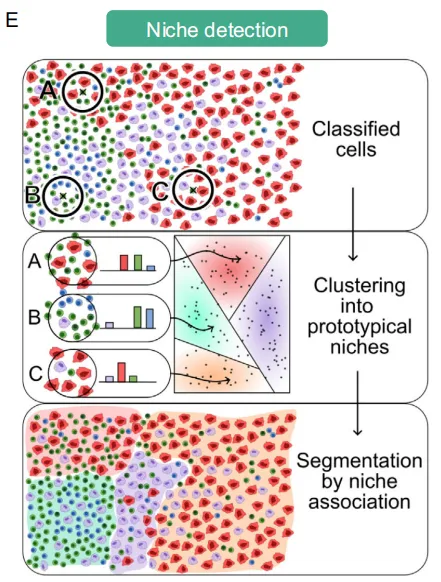
统计细胞在34nm邻域细胞数量——分别针对LUAD和LUSC邻域向量聚类——确定每个肿瘤的生态位分布
Fig 2 细胞表型学概述
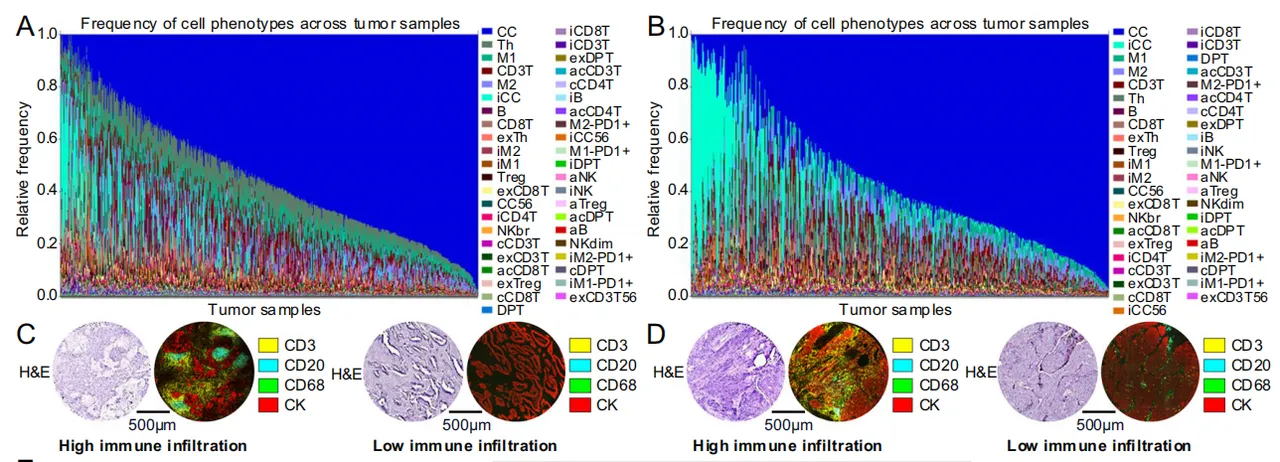
量化43种mIF衍生细胞类型的细胞组成(左LUAD右LUSC)其谱系范围从富含免疫细胞的‘热’型癌到免疫细胞匮乏的‘冷’型癌都有,体现多样性。LUSC与 LUAD 相比,显著更多肿瘤样本呈现高密度免疫抑制性癌细胞(iCC)。
层次聚类分析,LUAD 中免疫细胞高/低浸润及癌细胞含量相对低/高的肿瘤示例。LUAD 中通过层次聚类排序的热图(经z值标准化和对数转换以提高可视性)F和H是具有不同临床相关免疫状态的肿瘤示例。
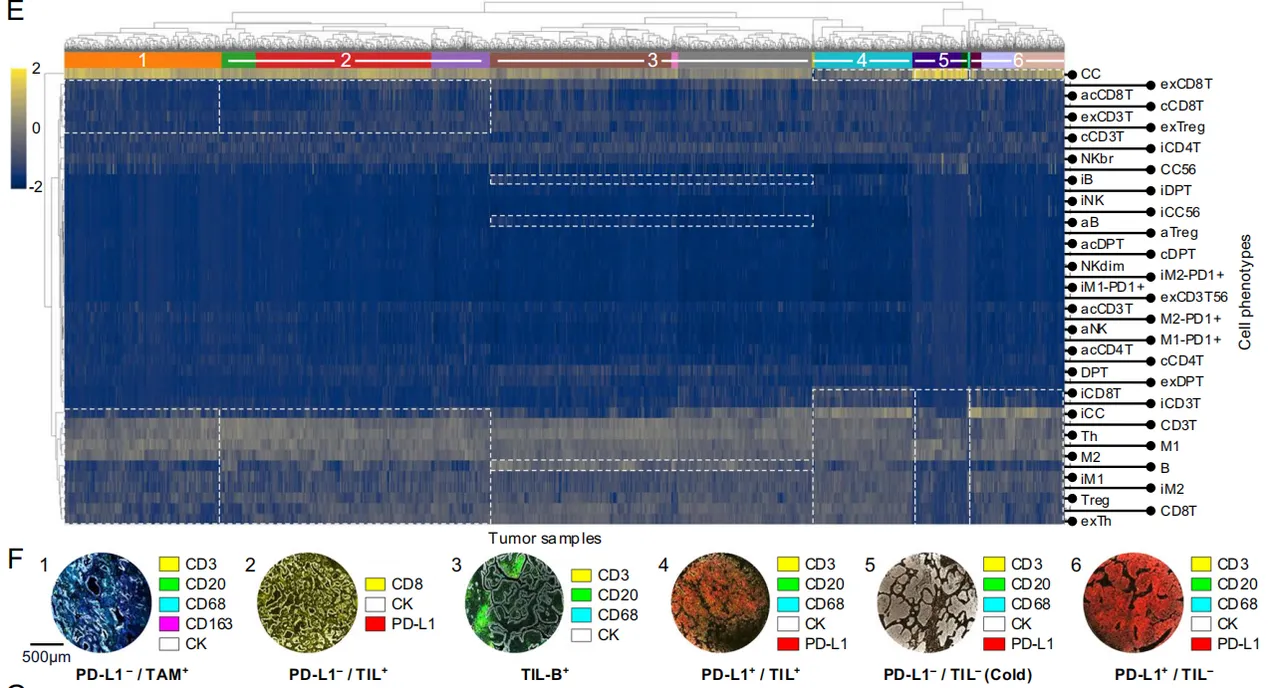
LUSC的
可以看出LUAD和LUSC是有很大差别的,
-
热肿瘤 = 癌细胞与大量T/B/巨噬细胞共存(往往PD-L1+);
-
冷肿瘤 = 癌细胞独大,免疫稀疏;TME 中缺乏T细胞(PD-L1−;TIL−)
-
特殊亚型 = B细胞聚集(TLS-like)或巨噬细胞独霸。
与 LUAD 相比, LUSC 的‘冷’型肿瘤比例更高(14.8% vs. 5.6%)
此外,聚类分析识别出一个具有较高淋巴细胞比率(435.34/)的癌组(LUADcluster组2; LUSC cluster 5)
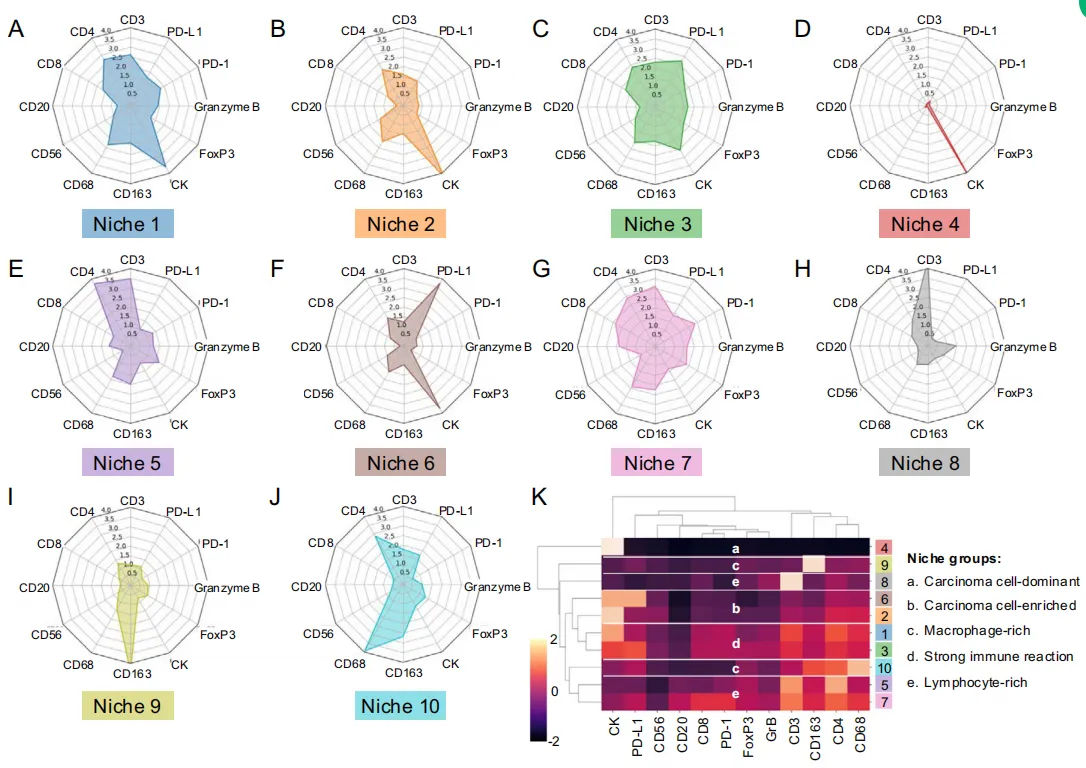
Fig 3 LUAD 中的生态位组成、分布及格局
根据前面图1E已经计算的了34微米邻域内不同细胞类型的细胞数量,我们识别出10个不同的细胞邻域,称为“细胞生态位”。每个生态位的组成通过雷达图可视化,突出显示底层表达标记物的比例。
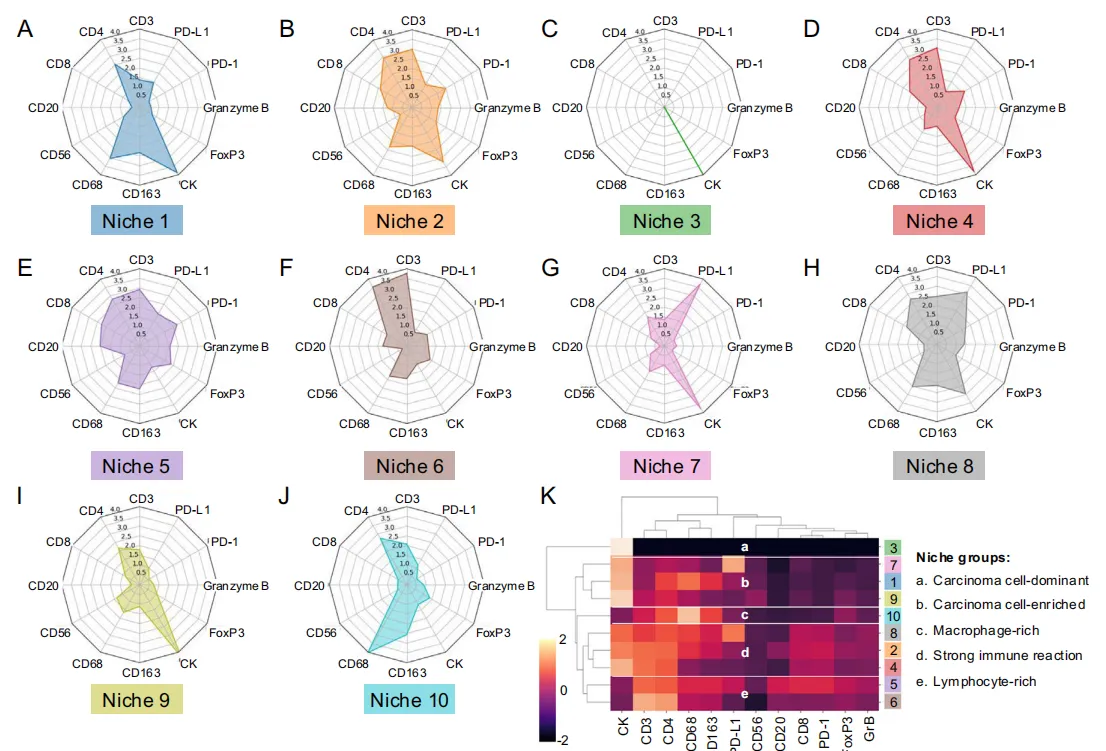
生态位1:CK⁺为主,伴中等CD4⁺、CD68⁺。
生态位2/4:CK⁺中高,CD3⁺/CD4⁺/CD8⁺/PD-1⁺增多;2比4更多CD68⁺。
生态位3:几乎纯CK⁺。
生态位5:高CD3⁺/CD4⁺/CD8⁺/CD20⁺/CD68⁺/CD163⁺/FOXP3⁺,PD-1⁺/GrB⁺。
生态位6:CD3⁺/CD4⁺多,CK⁺少。
生态位7:CK⁺/PD-L1⁺高。
生态位8:CK⁺/PD-L1⁺/CD3⁺/CD4⁺/CD8⁺/CD68⁺/CD163⁺均中等。
生态位9:CK⁺高,免疫低。
生态位10:高CD68⁺,适量CD163⁺。
为了进一步比较微环境组成,我们基于表达标志物进行了聚类分析(图3K)。
LUAD 10个微环境归成4类:
1. 癌富集型(1/7/9):CK⁺主导,免疫少量→中等。
2. 癌-免疫热型(2/4/8):高CK⁺+高T/巨噬及PD-1/GrB,反应强烈。
3. 癌主导型(3):几乎纯CK⁺,独立成簇。
4. 免疫主导型(5/6/10):CK⁺稀少;5/6为CD3⁺淋巴富集,10为CD68⁺巨噬富集。
肿瘤谱系:从左“淋巴热5”经混合,到右“癌主导3”,异质性显著。
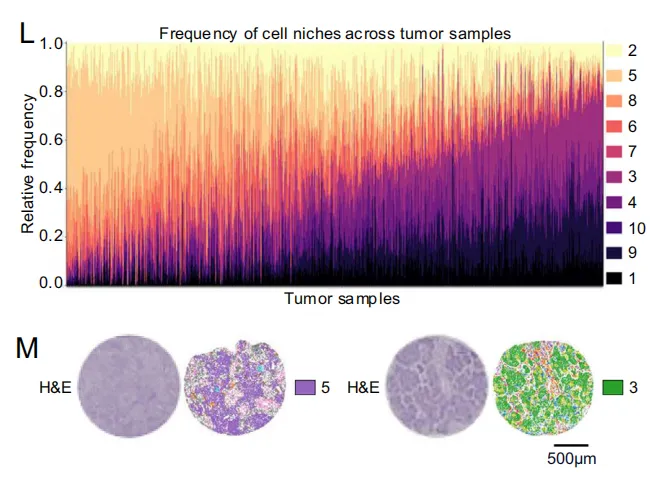
为刻画肿瘤微环境模式,我们对肿瘤样本进行层次聚类,得到4组(图3N):I冷-混合,II/III热-免疫,IV冷-癌富集。
-
组I:癌细胞主导/富集型微环境(1、3、7、9)为主,伴免疫强烈型(2、4、8),淋巴或巨噬细胞富集型稀少。
-
组II:淋巴富集型6和巨噬富集型10增多,癌细胞主导型减少,免疫强烈型8仍高。
-
组III:类似II,但癌细胞主导型比例回升。
-
组IV:癌细胞富集型7、8显著占优,免疫浸润最少。
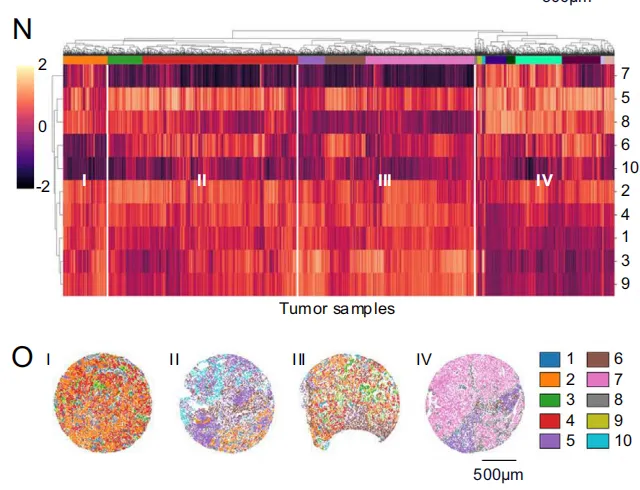
为全面掌握生态位模式的分布与集中情况,画umap根据样本的生态位特征定位其位置
具有相似生态位特征的肿瘤样本明显形成不同群组,这些群组与前述描述的生态位群及聚类结果高度吻合。
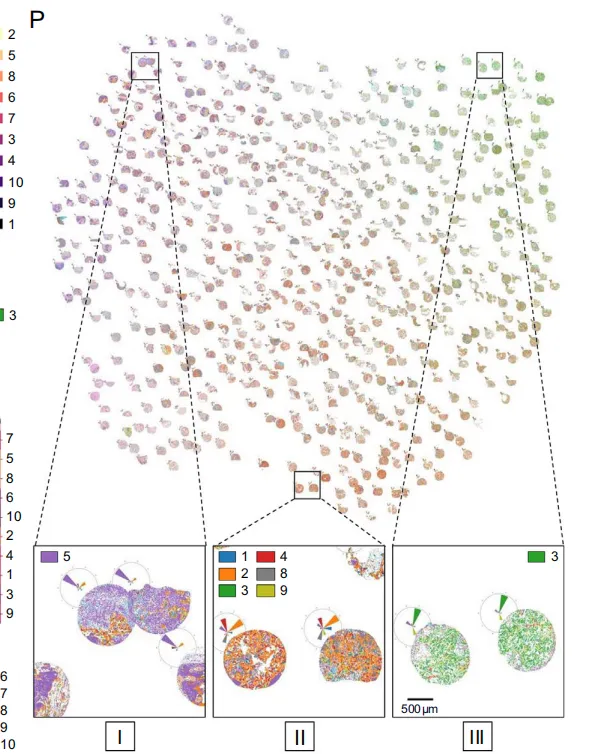
Fig 4 LUSC 中的生态位组成、分布及格局
LUSC 10 个微环境按免疫-癌细胞比例及标志物表达可归纳为 4 大类型、10 个具体亚型:
-
癌富集低-中免疫
-
微环境 2:CK⁺主导,仅零星 CD68⁺/CD3⁺/CD4⁺。
-
微环境 6:CK⁺+PD-L1⁺,免疫成分仍稀少。
-
-
癌富集强免疫(热)
-
微环境 1:高 CK⁺,伴中等 CD3⁺/CD4⁺/CD68⁺/PD-L1⁺及活化耗竭标志 PD-1⁺/GrB⁺。
-
微环境 3:CK⁺与 PD-L1⁺、CD3⁺/CD4⁺/CD8⁺、CD68⁺/CD163⁺均呈高水平,免疫反应最强烈。
-
-
癌主导(免疫沙漠)
- 微环境 4:几乎纯 CK⁺,其他标志物极少,独立成簇。
-
免疫主导(癌细胞稀少)
- 淋巴细胞富集亚组
– 微环境 5:大量 CD3⁺/CD4⁺。
– 微环境 7:CD3⁺/CD20⁺/CD68⁺及 PD-1⁺/GrB⁺全面高。
– 微环境 10:CD3⁺高,同时含部分巨噬。
- 巨噬细胞富集亚组
– 微环境 8:CD68⁺/CD163⁺双高。
– 微环境 9:以 CD163⁺巨噬为主,CD68⁺次之。
整体分布呈现从“癌主导-冷”到“免疫主导-热”的连续谱系,与 LUAD 类似但比例不同,凸显 LUSC 特有的微环境构成。
在 LUSC 中,生态位分布同样呈现显著异质性(图 4L),但其模式与 LUAD 存在两点鲜明差异:
-
单一优势生态位的“纯净”肿瘤明显减少,更多样本呈现 2–3 种生态位共存(样本内/簇内熵值 permutation test,p<0.001)。
-
尽管如此,仍可观察到两个极端群体:左侧高峰由癌细胞主导型生态位 2 与 4 构成;右侧高峰则由免疫富集型生态位 3 与 7 占据,与 LUAD 的“冷-热”双峰分布一致。
在此基础上进行层次聚类,LUSC 肿瘤被划分为 4 个特征性簇组(图 4N):
-
簇组 I:以淋巴细胞优势(5、7)和巨噬细胞优势(10)生态位为主,同时包含强烈免疫反应的癌富集区(1、3);癌细胞优势区(2、4、6)占比低,整体呈“免疫热”特征(图 4O 左例)。
-
簇组 II:1、3、5、7 生态位均保持高占比,癌富集区比例居中,呈现“癌-免疫均衡”格局(图 4O 中左)。
-
簇组 III & IV:癌细胞富集型生态位 6 显著升高,3 与 7 仍维持高水平;区别在于 III 组同时保留更多 1、2、4 型生态位,而 IV 组则以 6 型为主导,免疫浸润相对减少(图 4O 中右、右例)。
UMAP 生成的生态位图谱(图 4P)进一步验证了上述分组:
-
3-6-7 高占比群对应簇组 I
-
2-4 混合群对应簇组 III
-
1-3-5-7-8 高密度群对应簇组 II
综上,我们首次在单细胞精度下系统描绘了 LUSC 的空间生态位谱系,并与 LUAD 共同揭示出五类核心微环境:
-
癌富集-低免疫
-
癌富集-强免疫
-
癌主导-免疫沙漠
-
淋巴细胞主导
- 巨噬细胞主导
尽管框架一致,LUAD 与 LUSC 在各群组的具体发生频率及组合偏好上存在显著差异,体现了两种病理类型独特的肿瘤微生态格局。
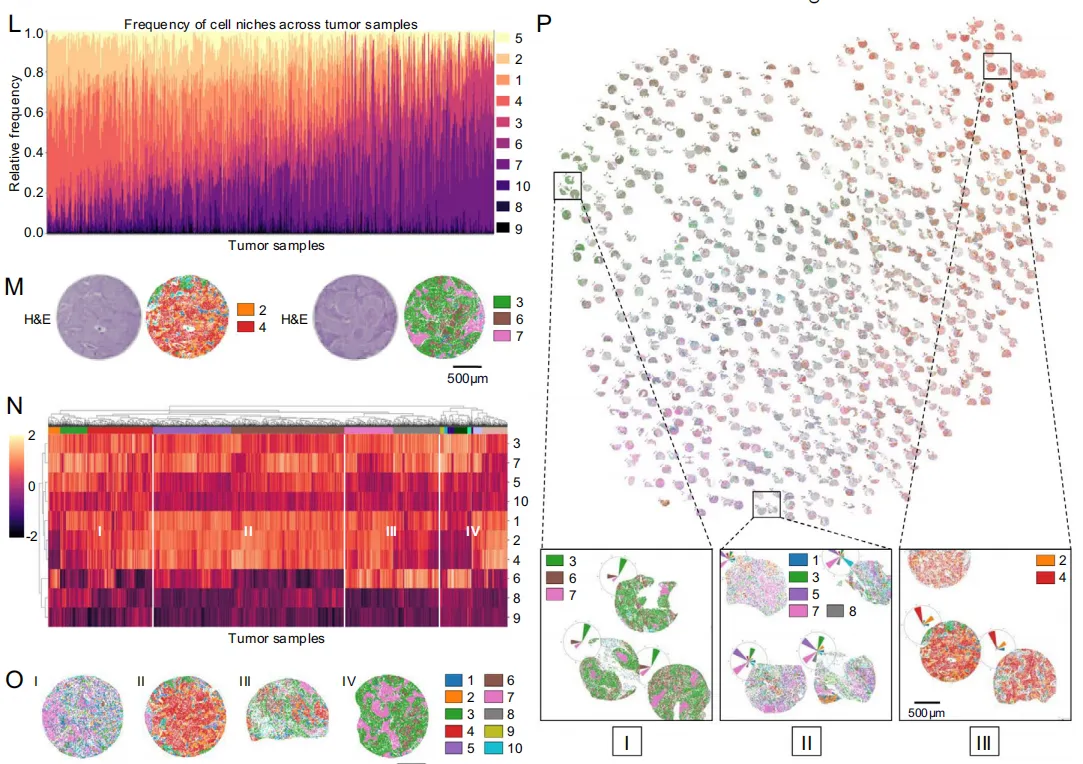
Fig 5 生态位组成与生物学解释
LUAD(左)LUSC(右)中各niche的细胞表型分布。
LUAD(左)LUSC(右)niches的mIF和H&E示例图像。
E:niches的免疫反应分类、图示组成和hot /cold分组(箭头连接LUAD/LUSC匹配niches)

将“生态位”翻译成细胞表型语言后,LUAD 与 LUSC 各自得到一份“冷热微环境目录”,共 12 个亚型;其中 8 个两癌共享,4 个为某亚型独有。
一、热生态位(6 个)
-
Inflhigh(炎-癌混合型)
-
代表:LUAD-8、LUSC-3
-
组成:免疫抑制性癌细胞 27–31%,T/巨噬/NK 合计 45–50%,PD-1⁺/GrB⁺ 活化-耗竭信号强。
-
形态:癌巢内散在大量 CD3⁺/CD68⁺ 细胞,PD-L1 中-高表达。
-
-
Leucohigh(强免疫浸润型)
-
代表:LUAD-2、LUSC-1
-
组成:癌细胞≈50%,余为混合免疫:辅助 T 12%、CD8⁺ 3%、细胞毒性 T 1%、巨噬 13%,B 细胞少量。
-
形态:癌区与免疫细胞交错,无明确淋巴滤泡。
-
-
Lymphigh I(淋巴细胞富集 I 型) B细胞5–7%(CD20⁺),早期/不典型 TLS,预后较好
-
代表:LUAD-6、LUSC-5
-
组成:淋巴细胞 80–90%(CD3⁺ 为主),癌细胞 ≤2%,巨噬少量。
-
形态:大片淋巴浸润,癌岛被包围。
-
-
Lymphigh II(淋巴细胞富集 II 型,LUSC 独有) B细胞10–12%,且形成小滤泡,典型 TLS,含 B 滤泡 + T 区,预后更好
-
代表:LUSC-8
-
组成与 Lymphigh I 类似,但 B 细胞比例略高,癌成分 <2%。
-
-
Tcellhigh(T 细胞优势型,LUAD 独有)
-
代表:LUAD-4
-
组成:T 淋巴细胞 75%,B 细胞 5%,巨噬 10%,癌细胞 10%。
-
形态:弥漫性 T 浸润,罕见 B 滤泡。
-
-
TLShigh(三级淋巴结构型)
-
代表:LUAD-5、LUSC-7
-
组成:B 细胞 10–15%,T 细胞 55–60%,Treg 6–7%,NK 1%,巨噬 20% 左右,癌细胞 ≤3%。
-
形态:典型 TLS,含 B 细胞滤泡 + T 区,高内皮小静脉附近常见。
-
二、冷生态位(6 个)
-
ImmuNULL(免疫荒漠型)
-
代表:LUAD-3、LUSC-4
-
组成:>95% CK⁺ 癌细胞,几乎无免疫。
-
形态:HE 染色呈“裸”癌巢,mIF 背景干净。
-
-
Immunosuphigh(免疫抑制排斥型)
-
代表:LUAD-7、LUSC-6
-
组成:免疫抑制癌细胞 65–71%,免疫细胞 ≤6%,PD-L1 高。
-
形态:癌巢周缘可见被“排斥”的稀疏 CD3⁺ 细胞,内部免疫缺如。
-
-
Leucolow(弱免疫浸润型)
-
代表:LUAD-9、LUSC-2
-
组成:癌细胞 >80%,淋巴/巨噬各 <5%,PD-1 低。
-
形态:偶见零星淋巴,无聚集团。
-
-
Mφhigh I(巨噬主导 I 型) 巨噬CD68⁺/CD163⁺ 混合(M1+M2)
-
代表:LUAD-10、LUSC-10
-
组成:巨噬 90–92%(CD68⁺/CD163⁺ 混合),癌细胞 <5%。
-
形态:癌间质区被大片巨噬取代,癌岛缩小。
-
-
Mφhigh II(M2 巨噬主导 II 型,LUSC 独有) 巨噬93% CD163⁺ 纯 M2
-
代表:LUSC-9
-
组成:CD163⁺ M2 巨噬 93%,CD68⁺ 少量,癌细胞 <5%。
-
形态:mIF 显示 CD163 强阳环,CD3 几乎缺如。
-
-
Mφint(TAM-癌交界型,LUAD 独有)
-
代表:LUAD-1
-
组成:癌细胞 81%,TAM(CD68⁺)16%,淋巴 <3%。
-
形态:癌巢边缘与 TAM 混编,呈“浸润-交界”图像。
-
三、共享与独有速览
-
两癌共享 8 个:Inflhigh、Leucohigh、Lymphigh I、TLShigh、ImmuNULL、Immunosuphigh、Leucolow、Mφhigh I
-
LUAD 独有 2 个:Tcellhigh、Mφint
-
LUSC 独有 2 个:Lymphigh II、Mφhigh II
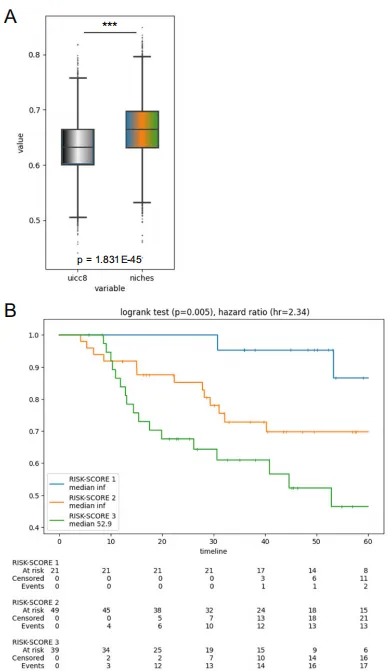
Fig 6 LUAD 生存预测与风险评分
A:UICC8 vs. niche模型c-index引导分布。 横轴:500 次自助抽样的 c-index 值;纵轴:密度。右上角 p<0.001(Mann-Whitney U)→ 生态位模型显著优于 UICC8,相对提升 14%。
B:基于niche风险评分的Kaplan-Meier曲线。 纵轴:OS 概率;横轴:术后月数。
-
生态位模型把 109 例 Cologne 验证队列按风险得分三等分: – RS1(低危,蓝):5 年 OS ≈ 90% – RS2(中危,橙):5 年 OS ≈ 65% – RS3(高危,红):5 年 OS ≈ 35%
-
Log-rank p<0.001 → 三曲线分离显著,模型能拉开生存差距。
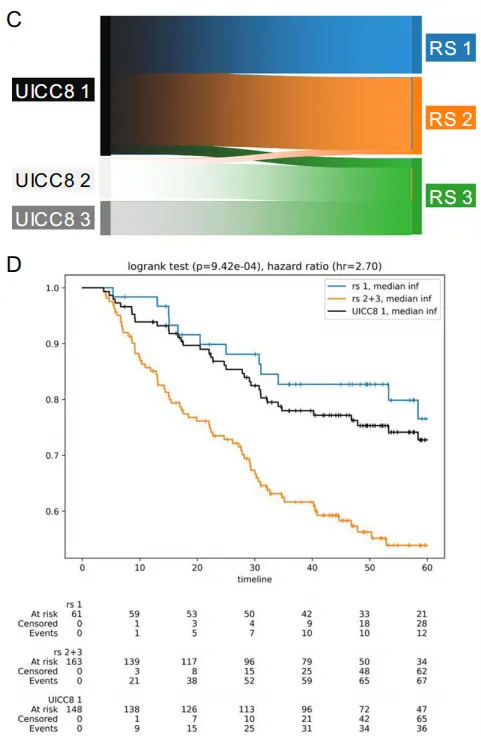
C:从UICC8到niche风险的重分类Sankey图。 把近六成 UICC I 期重新划为中危。
-
左柱:UICC 分期(I-II-III);右柱:生态位风险 RS1-2-3。
-
关键流线:UICC I 期病人 148 例 → 61 例仍留在 RS1,但 87 例被重新划入 RS2(中危)。
-
临床含义:约 59% 的“早期”病人被模型识别为潜在高危,可能需要考虑辅助化疗。
D:UICC8 I期患者的风险重分层Kaplan-Meier曲线。
-
仅画原 UICC I 期病人(n=148)。
-
黑线:按 UICC 不再细分,5 年 OS ≈ 75%;
-
蓝/橙线:按生态位再分 RS1 vs RS2,OS 差距拉开到 90% vs 55%,p<0.001。
-
说明模型能在“看似同一期”里挑出真正的高危个体。在 I 期内部再拉开 35% 的生存差距。
E:风险评分1的特征niche模式肿瘤示例(含丰度条形图)。 红是热肿瘤,蓝是冷肿瘤。Leucohigh、Inflhigh、Tcellhigh 等热生态位显著富集;冷生态位几乎不出现。
F:风险评分2的示例。 热、冷比例接近;TLS-high 与 Immunosuphigh 同时出现;提示“免疫-癌对峙”状态,对应中等预后。
G:风险评分3的示例。冷生态位霸屏:ImmuNULL、Immunosuphigh、Mφhigh I 显著富集;热生态位罕见 → 免疫沙漠或巨噬抑制主导,对应最差预后。
低危=热区主导,中危=冷热混合,高危=冷区主导
-
低风险组(RS1) = “热”生态位大杂烩:Leucohigh、Inflhigh、Tcellhigh 等淋巴细胞/炎症区占主导,TIL 多 → 预后好,跟文献一致。
-
中-高风险组(RS2-3) 出现两大变化: – B 细胞+Treg 高的 TLShigh 和 Lymphigh I 反而增多,提示“有 TLS 不一定都好”,在 LUAD 里可伴随不良结局(与 Sorin 等结果呼应)。 – 冷区集体上线:ImmuNULL(免疫沙漠)、Immunosuphigh(免疫抑制癌)、Leucolow(弱浸润)和 TAM 主导的 Mφhigh 一起富集 → 癌区冷、巨噬抑制,预后最差。
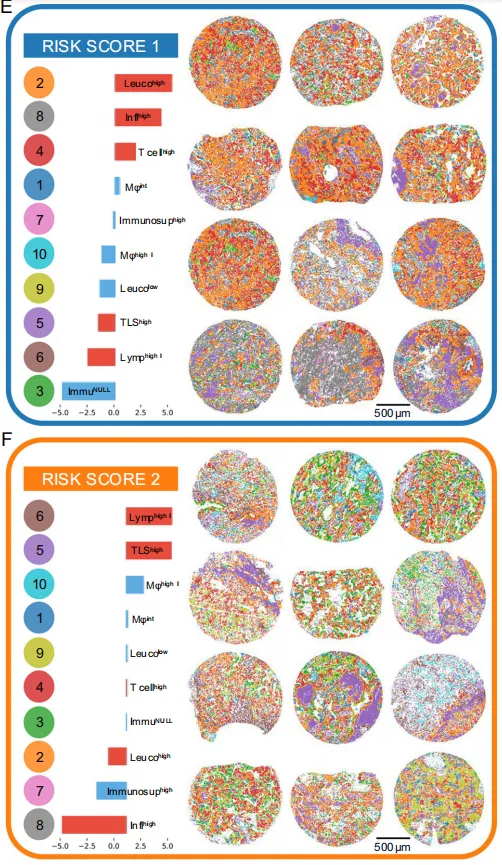
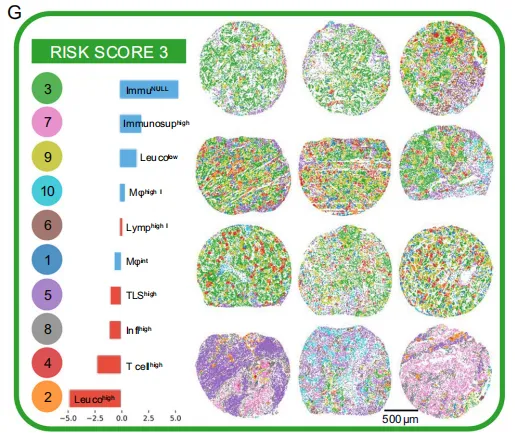
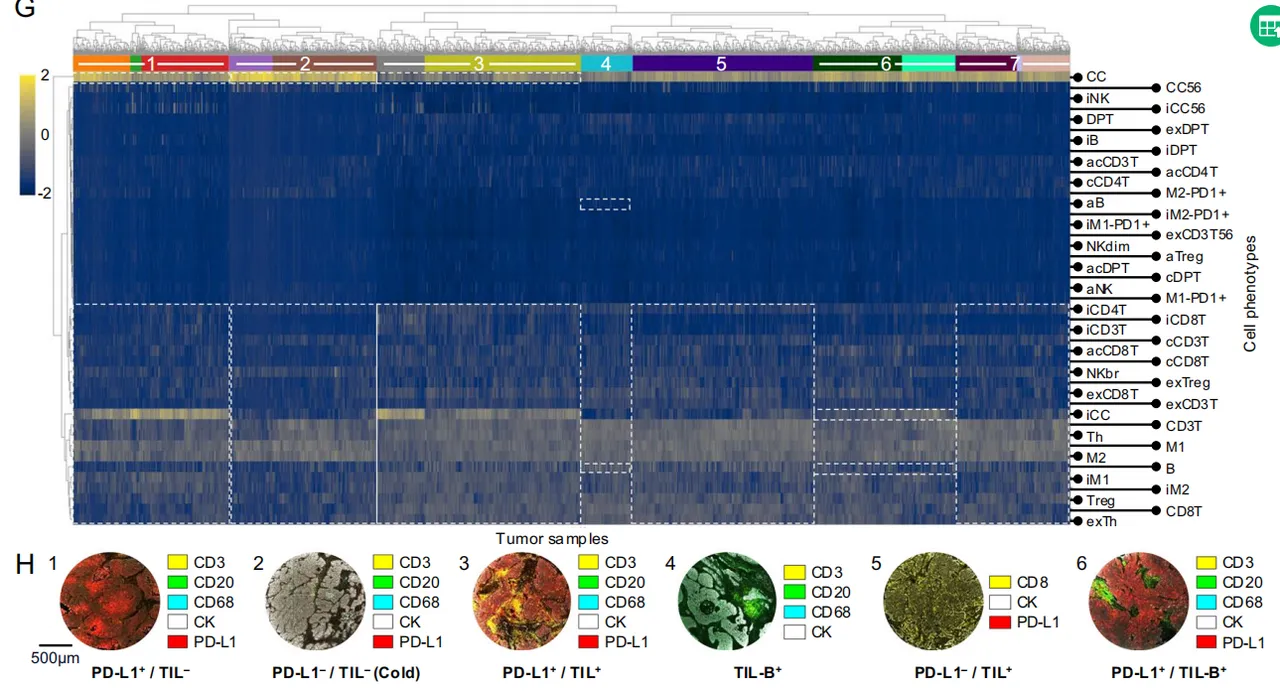
Fig 7 LUSC 生存预测与风险评分
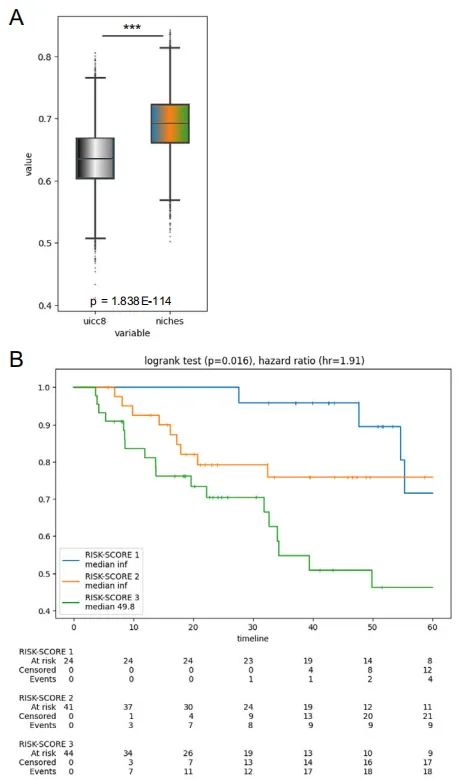
A:采用Bootstrap法对UICC8分期与微环境增强风险评分进行c指数比较
可见加上“空间生态位”后,预测能力猛涨,直接提升 47%,c-index 0.692
B:Kaplan-Meier分析,按细胞微环境生存模型分配的风险评分对患者(n=109)进行分层
C:Sankey图显示UICC8分期患者(n=109)向基于微环境风险分层的重新分配。大量UICC8 1期患者被重新归类为风险评分2(RS2),提示可能存在未充分治疗的高危患者。
D:UICC8 1期患者(n=163;黑色曲线)与风险评分重新分层(RS1=蓝色曲线,n=66例;RS2=橙色曲线,n=209例)的Kaplan-Meier分析。
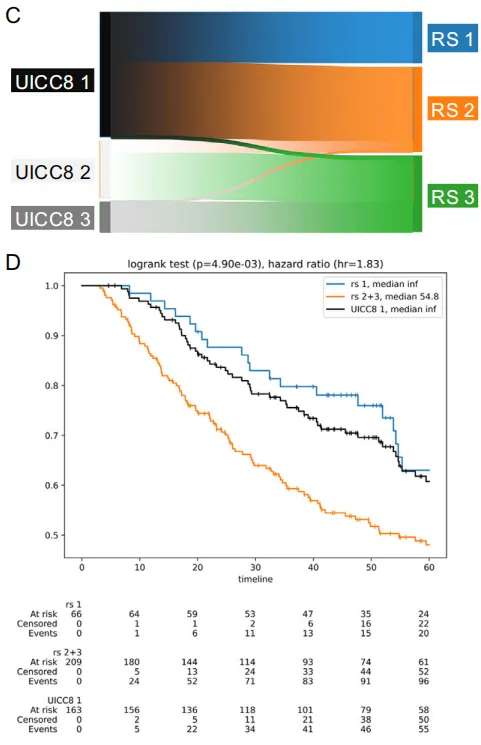
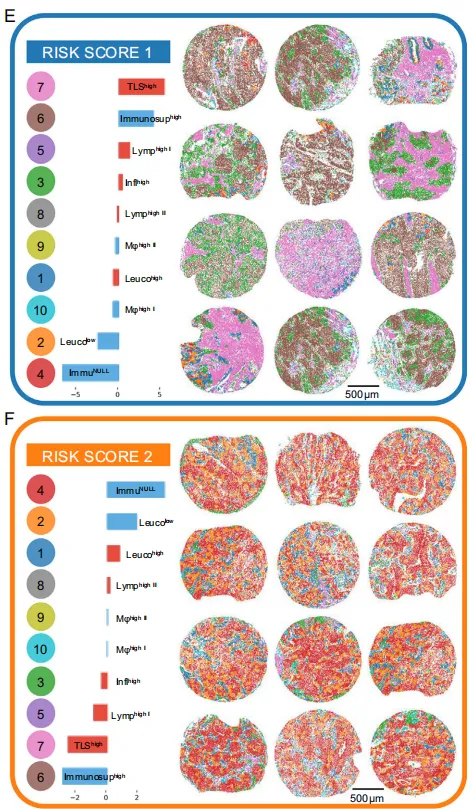
E:具有风险评分1特征性微环境模式的肿瘤样本(n=12)
F:针对风险评分2
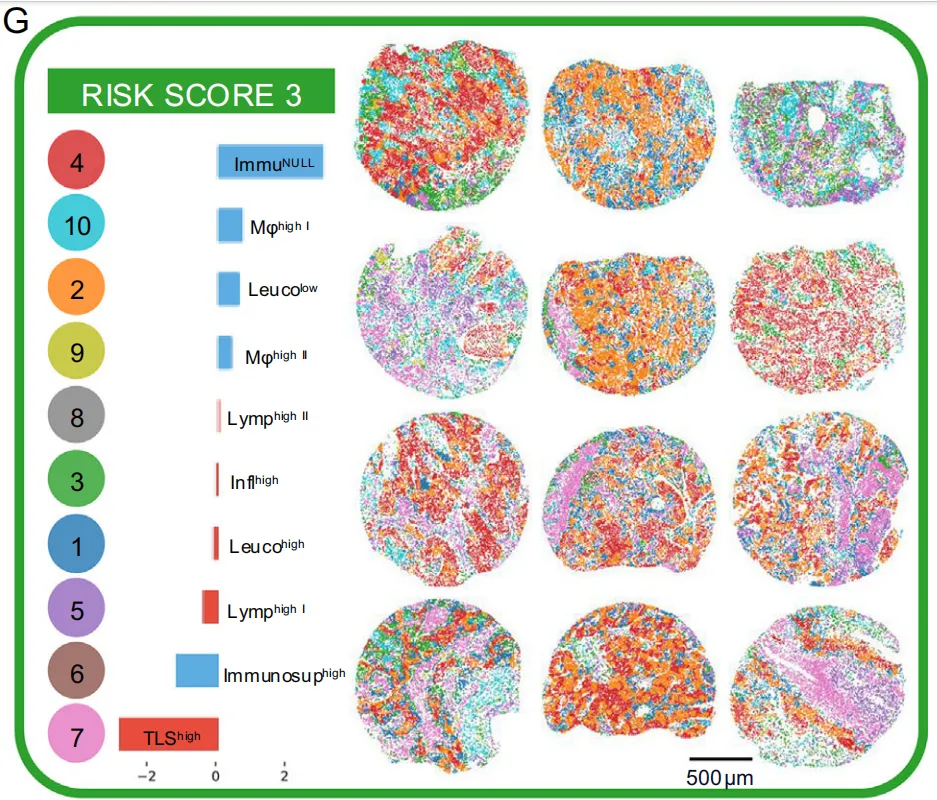
G:针对风险评分3
把LUAD和LUSC合起来看,得出结论:
“空间生态位”把早期肺癌再拆成“热/冷”两个世界:热区患者真低危,继续观察;冷区患者假低危,需要追加治疗。而且用几条小组织芯就能测出来,马上可以搬进真实病理流程。
① 加上“空间生态位”后,预测能力猛涨
-
LUAD:比 UICC 单独用提高 14%,c-index 0.665;LUSC 更夸张,直接提升 47%,c-index 0.692(图 6A/7A 的 bootstrap 分布)。
-
生态位模型 > 细胞密度模型(p<0.01)。 ⇒ 首次证明“细胞怎么摆”比“数细胞”更决定生死。
② 近一半“早期”病人被重新划风险
-
现行指南里只开刀的 UICC Ⅰ 期,约 50% 被生态位模型推到 RS2(中高危),生存曲线立刻掉到 UICC Ⅱ 期水平(图 6D/7D)。
-
换句话说:模型把“假低危”拎出来,这些人本该考虑辅助化疗。 ⇒ 这是“范式转变”——Ⅰ 期不再一刀切,而是“热生态位=真低危,冷生态位=假低危”。
③ 冷热生态位各有“面孔”
-
RS1(低危):热区当家 → Leucohigh、Inflhigh、Tcellhigh、TLShigh(有 TLS 滤泡)。
-
RS2-3(中-高危):冷区抱团 → ImmuNULL(免疫沙漠)、Immunosuphigh(抑制癌)、Leucolow、Mφhigh(巨噬抑制)。
-
LUAD vs LUSC 有细节差:LUAD 的 TLS 在高危也可出现;LUSC 的 TLS 只在低危,高危纯冷。 ⇒ 临床不能只看“有没有免疫细胞”,要看“哪种细胞+哪个生态位”。
④ TMA 打小样 ≈ 全切大片
-
同一患者的 4 条 1.5 mm 核心与整张手术切片的风险评分高度一致(r=0.979 LUAD,0.997 LUSC,图 8)。
-
肿瘤内异质性 < 肿瘤间异质性 → 几条小核心就能代表全瘤。 ⇒ 方法可落地:日常病理切几张 TMA 即可,无需整片扫描。
Fig 8 整体肿瘤切片上的生态位模式
风险评分1、2、3时LUAD和LUSC的微环境对比。TMA核心可靠代表全肿瘤,支持该方法在临床常规TMA上的可行性。
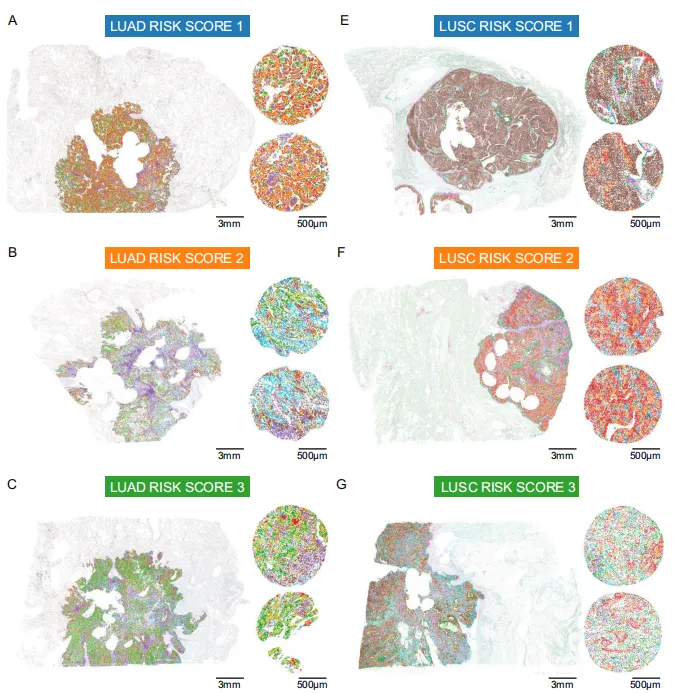
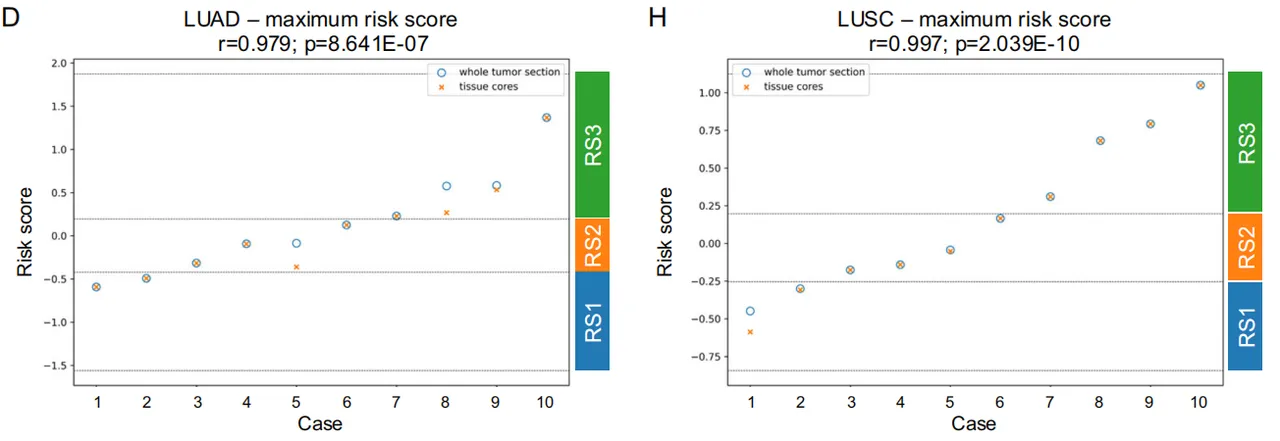
结果显示风险评分具有高度相关性,且风险分组(图8A-D;Pearson相关系数r=0.979;p<0.0001****)与 LUSC(图8E-H;Pearson相关系数r=0.997;p<0.0001****)完全一致。
讨论及局限性
指出理解肿瘤微环境(TME)的复杂性及其对肿瘤生物学和治疗策略的影响仍是癌症研究的主要挑战。本研究基于先前工作(如Chen B. et al.和Kinoshita T et al.关于TME预后价值的研究,以及近期关于细胞空间排列影响疾病进展和治疗反应的证据),开发了一种多模态AI驱动的TME分析方法,揭示了肺癌中预测肿瘤生物学行为的空间细胞“niche”模式。
结合多重成像与多模态AI,识别临床相关的空间细胞邻域,超越传统肿瘤分类,考虑TME中不同细胞类型的微观尺度互动。AI模型在患者结局预测上优于当前临床金标准(UICC8分期系统),提示NSCLC风险分层可能发生范式转变,推动向基于个体肿瘤细胞组成的精准医学发展。
结果支持假设:不仅仅是免疫和间质细胞的定量组成,其空间组织对肿瘤行为理解 也至关重要。将空间模式纳入诊断过程,可识别当前仅靠UICC8被归为低风险的肺癌 患者中的低/高风险亚群。这在临床上高度相关,因为I期患者按现行指南不接受辅助治疗,但本研究识别的高风险亚群预后类似于II期患者,应考虑辅助治疗。该12- plex mIF方法稳健,有望在不久的将来实现更广泛的诊断应用。
局限性与验证需求:
尽管在德国两个独立队列上训练和验证,但需在更广泛患者群体中进一步评估以推动临床实施。目前不清楚观察到的niche模式是否为通用微环境属性,可否转移至其他癌种。高品质mIF成像目前仅限于专业中心,尽管方法稳健,但仍需扩展。
未来研究方向
未来应在更广泛人群中验证和优化细胞niche模式的预测能力。特别提到癌相关成纤维细胞(CAFs)是重要间质细胞群体(引用Cords et al.工作),但本研究未发现纤维细胞丰度与风险评分的显著关联(因mIF面板未包含CAF亚型标记,以简化临床适用性)。建议未来评估纳入CAF亚型的额外价值;整合多组学数据深入niche形成机制;利用可实验扰动的模型系统建立niche模式与肿瘤行为/治疗反应的因果关系,揭示潜在治疗靶点。
由于方法内容比较多,在这里我就不写啦,感兴趣可以去看原part!
病人 → TMA打芯 → 12 标染色 → UNet 分癌/间质 → StarDist 找核 → ConvNeXt 分型 →用 DAPI 做“锚”,后续把 mIF 与 H&E 像素级对齐 →34 μm 邻居聚类 → 10 维生态位 → Cox 风险模型正则,连续风险得分用 max-pooling(取患者 4 点中最高风险) → Berlin 训练 训练集(n≈786),Berlin 内部 5 折交叉验证挑 α & 特征数(贪心算法,在 Berlin 训练集内部用来选“最相关又最不冗余”的变量,一旦选完就退出,后续 Cologne 验证不再碰它) → 锁定超参数/ Cologne 验证 独立验证集(n≈382) → 冷热决定治疗。