Non-invasive multimodal CT deep learning biomarker to predict pathological complete response of nonsmall cell lung cancer following neoadjuvant immunochemotherapy: a multicenter study

作者:
Guanchao Ye,1,2 Guangyao Wu,3 Yu Qi,1
期刊:journal for immunoTherapy of cancer
重要指数:⭐️⭐️⭐️⭐️⭐️
时间:24.08.04
关键词:多模态 CT 融合\FM-LCT\病理完全缓解(pCR)
摘要:
目的 尽管新辅助免疫化疗已广泛应用于非小细胞肺癌(NSCLC)治疗,但预测治疗反应仍具挑战性。本研究采用治疗前多模态CT技术探索基于深度学习的免疫化疗反应影像生物标志物。
方法 本研究回顾性获取2019年8月至2023年2月期间在多中心接受新辅助免疫化疗后手术的 NSCLC 患者的非增强CT和增强CT扫描图像。分别从非增强CT和增强CT扫描中提取深度学习特征构建预测模型(LUNAI -uCT模型和 LUNAI -eCT模型)。通过融合两种特征后构建融合模型(LUNAI -fCT模型)。采用受试者工作特征曲线下面积(AUC)、准确率、敏感性、特异性、阳性预测值和阴性预测值评估模型性能。运用SHapley加性解释分析量化CT影像特征对模型预测的影响。为深入理解模型预测机制,采用梯度加权类激活映射生成显著性热图。
结果 训练集和验证集包含来自中心A的113例患者(8:2比例),测试集包含112例患者(中心B n=73,中心C n=20,中心D n=19)。在测试数据集中, LUNAI -uCT、LUNAIeCT和 LUNAI -fCT模型的AUC值分别为0.762(95%CI0.654-0.791)、0.797(95%CI0.724-0.844)和0.866(95%CI0.821-0.883)。
结论:通过从对比增强和非对比增强CT中提取深度学习特征,我们构建了 LUNAI -fCT模型作为影像生物标志物,该模型可无创预测 NSCLC 新辅助免疫化疗的病理完全缓解。
1.研究背景
-
目前用于免疫治疗的生物标志物(如程序性细胞死亡配体1)需要侵入性操作且准确性有限。目前有单模态CT研究,但没有同时利用普通和增强CT的
-
新辅助免疫化疗的出现与病理完全缓解(pCR)患者比例的上升同步发生,术后残留肿瘤细胞的数量是关键预后因素,残留肿瘤负荷越低预后越佳。对于 NSCLC 患者,确认pCR是其生存时间的重要预测指标。
-
达到pCR的患者可能受益于“观察等待”策略,类似于直肠癌8和食管癌采用的观察策略。实施该策略有助于避免过度治疗,并可能延长生存期。研究表明,肺癌中过度淋巴结清扫会降低免疫治疗效果。对于pCR患者,避免彻底淋巴结清扫可能有助于在免疫维持治疗中获得更好疗效。然而,pCR的确切评估仍主要依赖于切除肿瘤的组织病理学检查,这凸显了需要一种无创、准确的免疫化疗后pCR识别方法。
-
然而,在评估新辅助免疫化疗的治疗反应时,影像学与病理学评估之间存在显著差异。在 NADIM 试验中,33%的影像学显示疾病稳定的患者和73%的部分缓解患者被判定为病理完全缓解(pCR)。这种差异通常源于淋巴细胞浸润导致的假性病灶,影像学表现可能无法反映实际肿瘤消退。有必要完善方法学以弥合影像学与病理学评估之间的差距。
-
本研究采用FM- LCT 模型从治疗前获取的非增强与增强CT图像中提取深度学习特征,随后融合这些特征并构建机器学习模型以预测病理完全缓解(pCR)。
-
该方法实现了对 NSCLC 新辅助免疫化疗期间肿瘤特征的多维表征,并成功开发出一种无创生物标志物以区分pCR。该方法具有辅助可切除 NSCLC 患者临床决策、预防过度治疗以及促进个性化精准癌症治疗的潜力。
2.研究框架
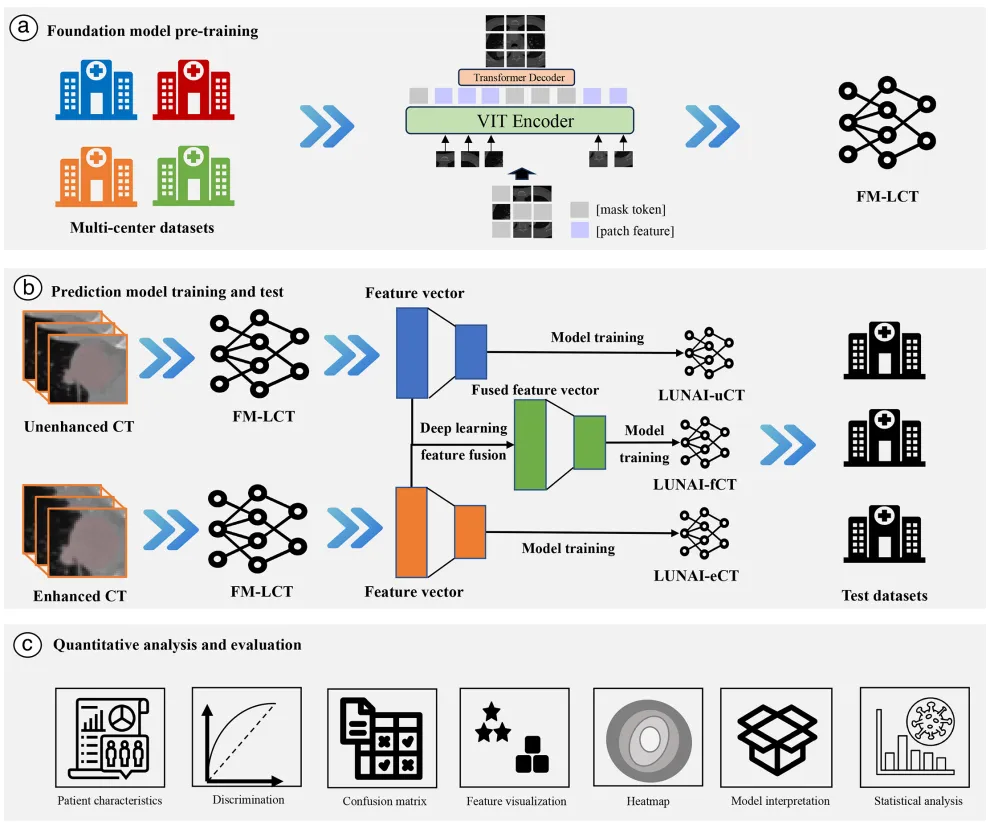
整体研究设计示意图。(a)采用掩码自编码器方法对基础模型进行预训练。(b)深度学习特征提取及预测模型训练与测试。(c)定量分析与评估,包括患者特征分析、预测模型评估及定量影像特征分析。
LUNAI -eCT:对比增强CT深度学习特征模型; LUNAI -fCT:非对比与对比增强CT融合深度学习特征模型; LUNAI -uCT:非对比增强CT深度学习特征模型。
3.研究实验与数据分析
Fig 3 预测模型的性能评估
队列情况:接受新辅助免疫化疗后手术的295例 NSCLC 患者。
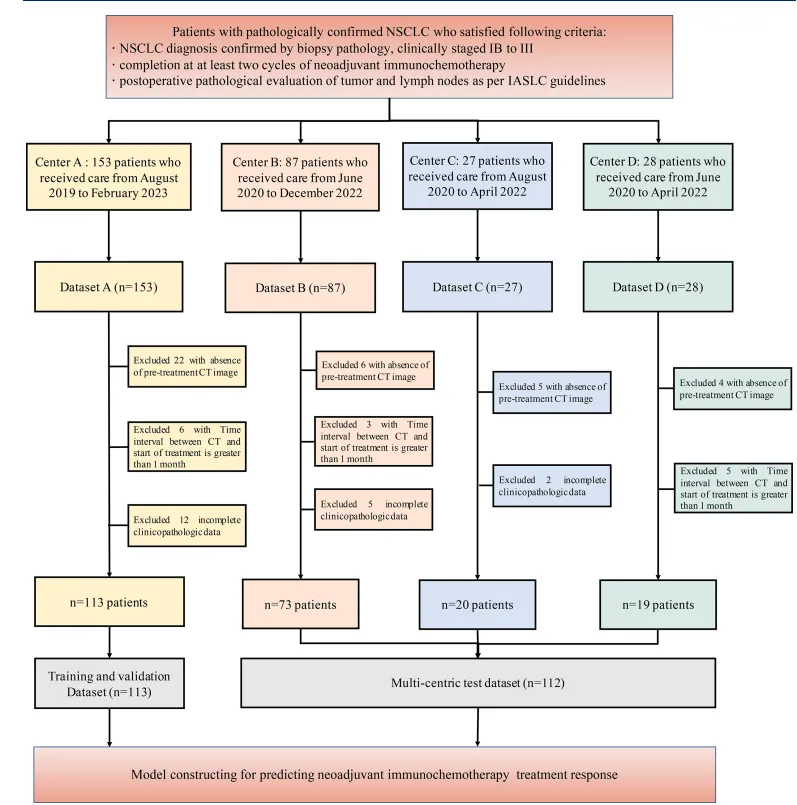
纳入标准包括:(1)经活检病理确诊 NSCLC ,临床分期IB至III期;(2)完成至少两个周期的新辅助免疫化疗;(3)根据国际肺癌研究协会(IASLC)指南进行肿瘤及淋巴结的术后病理评估。
排除标准包括:(1)缺乏治疗前CT影像;(2)治疗开始前CT影像拍摄超过1个月;(3)临床病理数据不完整。研究对象如图1所示流程图。临床病理数据包括年龄、性别、吸烟史、肿瘤及家族史、治疗前中性粒细胞与淋巴细胞比值、治疗前血清乳酸脱氢酶、治疗前白蛋白、治疗前临床分期、肿瘤部位、病理类型及术后病理反应。采用的肿瘤、淋巴结、转移(TNM)分期系统为 IASLC TNM 分期系统第8版。
胸部CT图像采用1600 HU的窗宽和-600 HU的窗水平进行回顾性分析。放射科医师(GW)与胸外科医师(GY)使用 ITK -SNAP(V.3.8.0,可访问http://www.itksnap.org/ )完成感兴趣区域(ROI)分割。放射科医师间的意见分歧通过讨论达成共识。随后由资深放射科医师评估ROI质量,并在初级放射科医师完成肿瘤病灶分割后进行必要调整。为评估稳健性,随机选取50例病例计算组内相关系数,≥0.75视为具有稳健性。
数据预处理:采用B样条插值法实现1mm各向同性维度的体素重采样,以及通过z分数法进行强度归一化。
特征提取和模型开发:
FM-LCT:特征提取,使用掩码自编码器(MAE)对比学习算法,主成分分析降维,随机森林。生成三个(非增强、增强、融合)
量化CT影像特征对模型预测的影响:SHapley加性解释(Shap)分析
梯度加权类别激活映射(Grad-CAM)生成显著性热图
采用Fisher精确检验、Pearson χ2 检验和Kruskal-Wallis检验,对训练集与外部测试集患者的特征进行比较。
3A:不同预测模型对病理完全缓解(pCR)的区分性能
3B:混淆矩阵
3C:基于年龄(≥60岁 vs <60岁)、吸烟状态(吸烟 vs 非吸烟)和治疗前总体分期(II期 vs III-IV期)的亚组分析
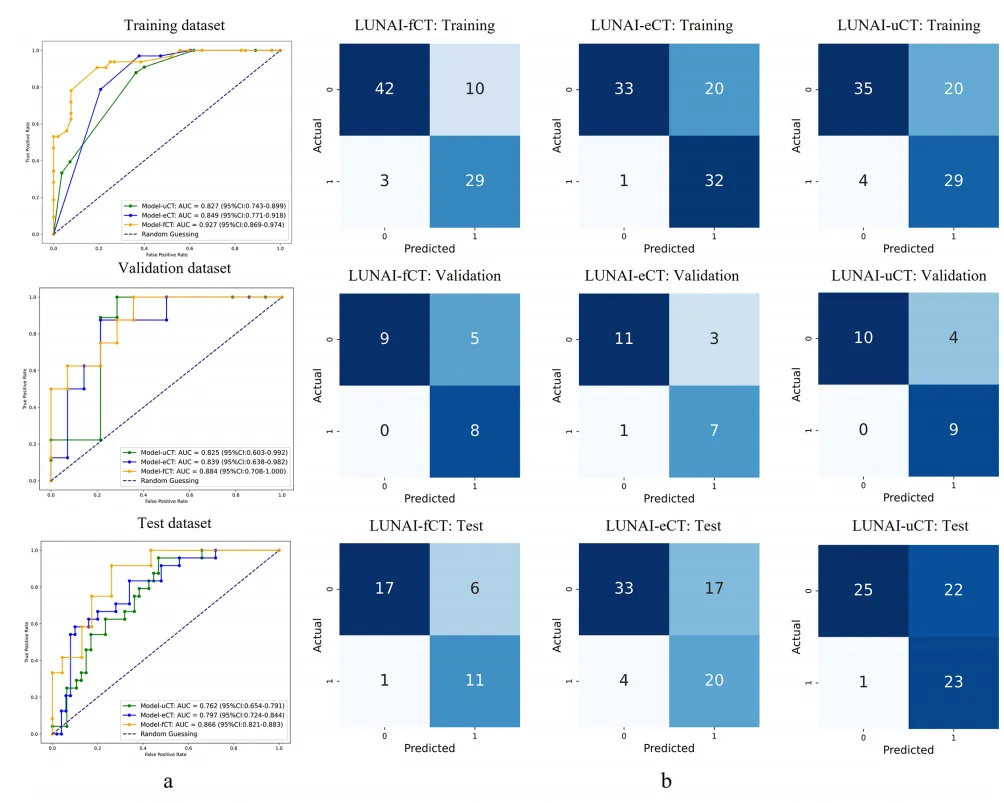
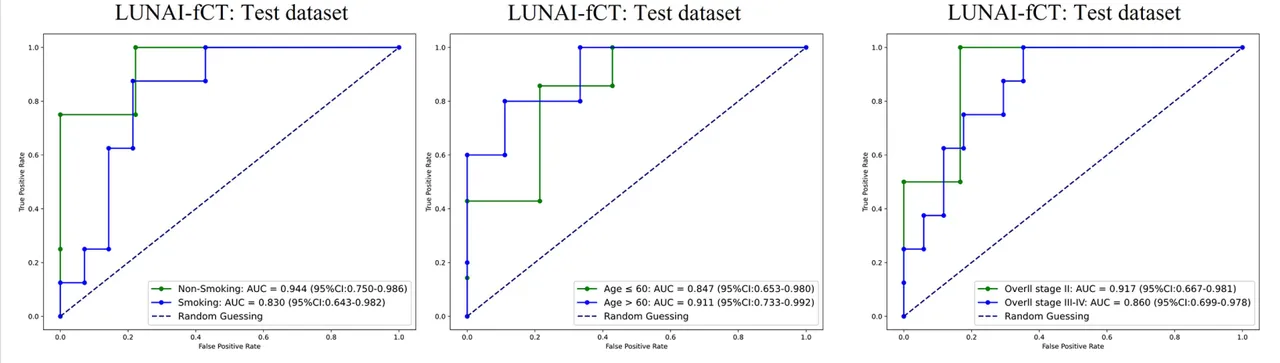
Fig 4 对所有患者群体中pCR组与非pCR组生成的Immu_TR评分进行统计分析
图4a–c:Immu_TR评分的Kolmogorov-Smirnov(KS)统计检验结果,融合的分界效果更好
图4d–f:t分布随机邻域嵌入
图4g–i:均匀流形近似投影
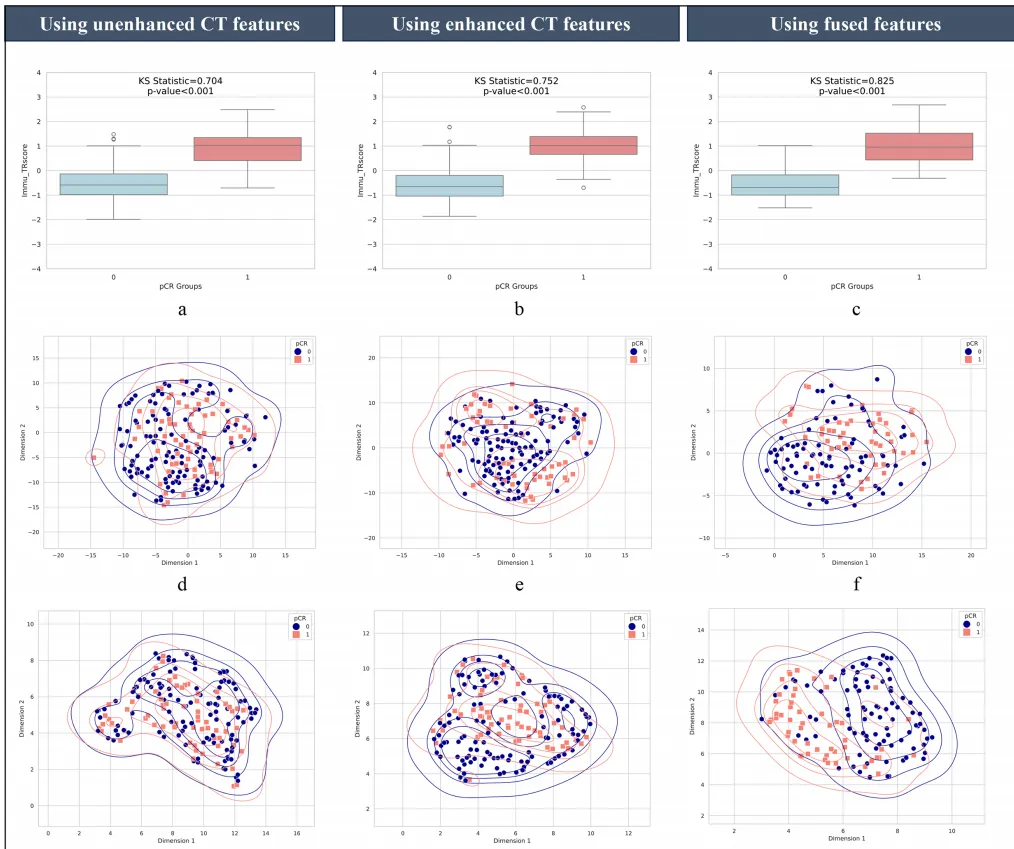
Fig 5 MScaleCT模型的性能
图5a:LUNAI -uCT特征1和2具有最高的绝对Shap值
图5b:LUNAI -eCT特征2和3贡献最为显著
图5c:LUNAI -fCT特征2和14具有最高的Shap值
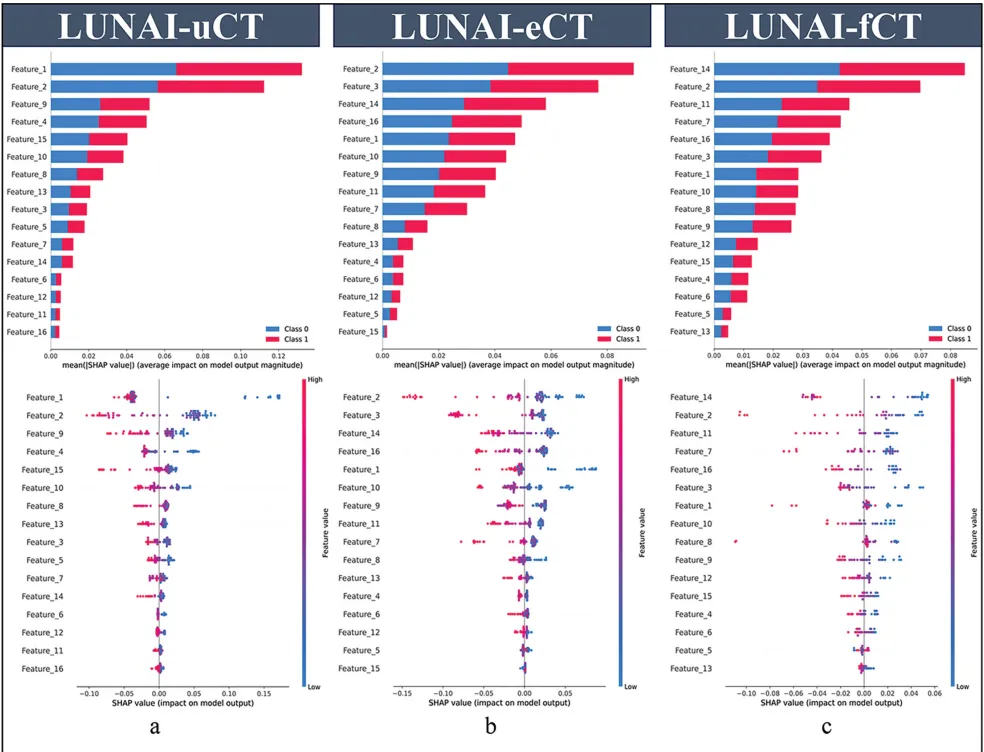
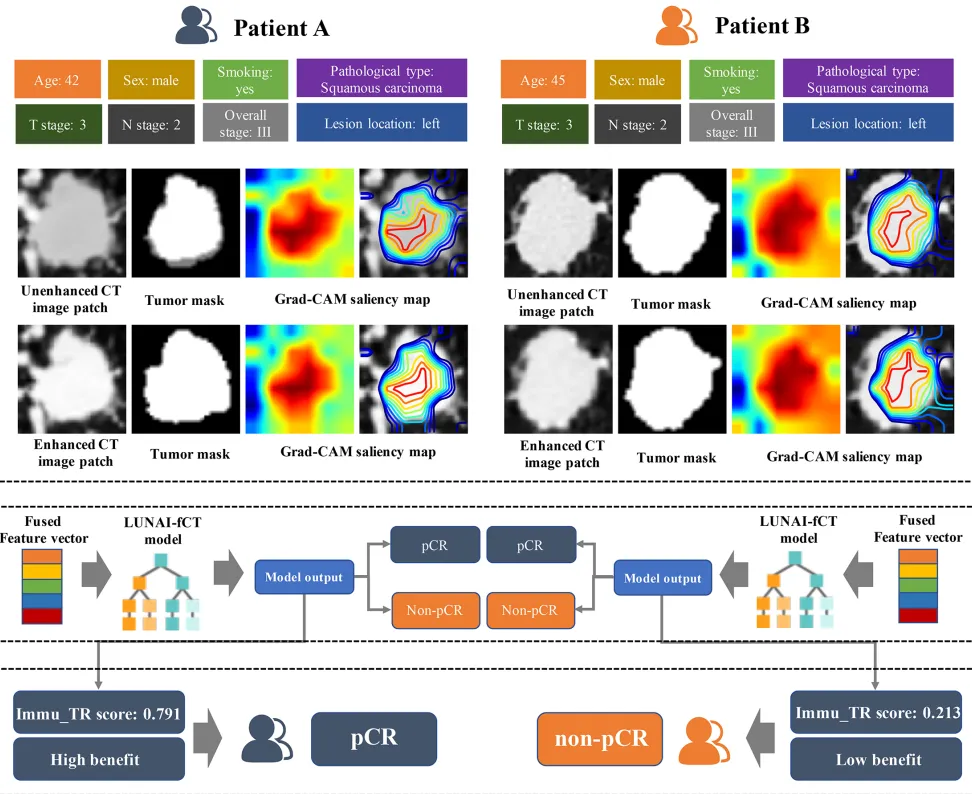
Fig 6 Immu_TR评分在两名临床特征相似患者中的示例应用
患者A和患者B在新辅助免疫化疗前具有相同的临床T分期、N分期、总体分期、吸烟状态、病理类型、病灶位置,以及相近的年龄和肿瘤体积。Grad-CAM显著性图显示,深度学习特征是从瘤内区域提取的。这两名患者的Immu_TR评分分别为0.791和0.213。病理评估证实患者A达到病理完全缓解(pCR),而患者B未达到。